Geneesmiddelenbewaking bij farmaceutische producenten
Plaats een reactieDe Inspectie voor de Gezondheidszorg heeft onderzocht in hoeverre farmaceutische vergunninghouders voldoen aan de Nederlandse en de Europese wetgeving. Veel vergunninghouders blijken hun zaken niet op orde te hebben.
Zowel volgens de Europese als de Nederlandse wet zijn houders van een farmaceutische handelsvergunning verplicht om een systeem te gebruiken voor geneesmiddelenbewaking (farmacovigilantie).1 2 Dit systeem moet voorzien in het adequaat verzamelen en analyseren van de bijwerkingen van geneesmiddelen waarvoor de handelsvergunning is afgegeven. De houder behoort deze meldingen tijdig te melden bij de autoriteiten die belast zijn met het toezicht op het naleven van de Geneesmiddelenwet. In Nederland is dat het College ter Beoordeling van Geneesmiddelen. De Inspectie voor Gezondheidszorg (IGZ) houdt toezicht op de systemen voor farmacovigilantie van de registratiehouders in Nederland en op het naleven van de betreffende wet- en regelgeving.
Eén van de verplichtingen is het beschikbaar hebben van een actuele en gedetailleerde beschrijving van het systeem voor farmacovigilantie, het zogeheten Detailed Description of Pharmacovigilance System (DDPS). Een DDPS moet volgens Volume 9a van de Europese wetgeving voldoen aan een aantal punten. Het gaat onder andere om een taakomschrijving van de gekwalificeerde persoon voor farmacovigilantie (Qualified Person for Pharmacovigilance, QPPV) en diens bereikbaarheid, een overzicht van de organisatie, een beschrijving van de gedocumenteerde procedures, een beschrijving van de database(s), een overzicht van de aanwezige contracten, een beschrijving van de (interne) training van personeel, de methoden voor archivering en beschrijvingen van het kwaliteitsmanagement systeem.
De IGZ heeft onderzoek gedaan om inzicht te verkrijgen in de aanwezigheid en compleetheid van de farmacovigilantiesystemen, onder andere ter onderlinge vergelijking tussen vergunninghouders, en om gericht inspecteren mogelijk te maken.
Methoden
Het College ter Beoordeling van Geneesmiddelen verstrekte medio 2010 een bestand met handelsvergunninghouders. Schriftelijk werden alle handelsvergunninghouders verzocht om de DDPS van hun organisatie op te sturen. Als een registratiehouder niet binnen de gestelde termijn reageerde, werd opnieuw een brief gestuurd met een tweede verzoek.
Er zijn 41 objectiveerbare punten geselecteerd (tabel 1). Bij ontvangst werden de DDPS-en beoordeeld op aan- of afwezigheid van deze 41 punten. Hierbij werd ook de volledigheid van de beschrijving van de punten in acht genomen. Twee toezichtmedewerkers voerden de beoordeling afzonderlijk uit; bij discrepantie werd de DDPS opnieuw bekeken en werd getracht consensus te bereiken tussen de twee toezichtmedewerkers, waarbij bij blijvende discrepantie het oordeel van de inspecteur doorslaggevend was. De beoordelingen werden in een geautomatiseerd bestand verwerkt en geanalyseerd.
Resultaten
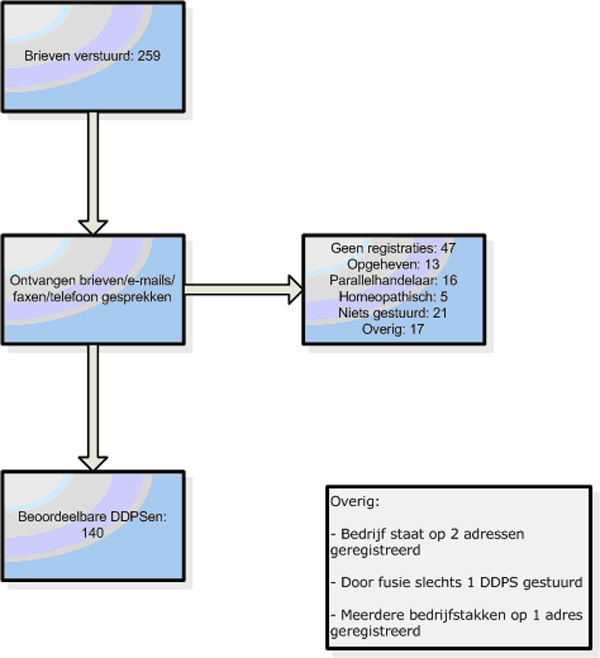
In totaal werden brieven verstuurd aan alle 259 handelsvergunninghouders in Nederland. Na herhaling van het verzoek bij non-responders leverde dit uiteindelijk 140 beoordeelbare DDPS-en op (figuur 1). Bij een aantal handelsvergunninghouders was de status quo veranderd; ze hadden nog wel een vergunning maar waren niet meer actief.
In 9,3 procent van deze 140 DDPS-en waren alle 41 punten nader uitgewerkt. In 61,9 procent van de DDPS-en was meer dan driekwart van de punten uitgewerkt; in 18,1 procent was minder dan driekwart van de punten voldoende uitgewerkt. In 10,7 procent werd op geen enkele wijze voldaan aan de objectiveerbare punten zoals deze aanwezig moeten zijn in overeenstemming met de Europese wetgeving.
Zoals gepresenteerd in tabel 2 was punt 1, de naam van de QPPV, met 85 procent het meest frequent weergegeven. Punt 25, namelijk een gedocumenteerde procedure voor de handelwijze om te voldoen aan de verplichtingen van de autoriteiten bij een handelsvergunning, was het minst frequent aanwezig in de DDPS-en met een percentage van slechts 60,7 procent. Het op één na minst frequent weergegeven vereiste betrof de locatie van het bestand voor het opslaan en verwerken van meldingen met een percentage van 64,3 procent. Hoewel enkele essentiële gedocumenteerde procedures frequent beschreven werden (punten 15, 18 en 20), worden andere procedures (punten 14, 16, 17, 19, 21-29) in slechts 25 procent van de DDPS-en voldoende belicht.
Discussie
De Inspectie voor de Gezondheidszorg heeft naar aanleiding van dit onderzoek geconstateerd dat veel handelsvergunninghouders niet voldoen aan de wettelijke verplichtingen. De samenvattingen van de farmacovigilantiesystemen van registratiehouders in Nederland zijn namelijk in slechts 71 procent van de gevallen voor ten minste driekwart in overeenstemming met de eisen van de Europese wetgeving. De naam van de QPPV is wel in de meeste gevallen gedocumenteerd in de DDPS maar aanwezigheid van een dergelijk elementair gegeven is dan ook fundamenteel. De beschrijvingen die het meest frequent ontbreken zijn de aanduidingen van bepaalde gedocumenteerde procedures. Hoewel deze resultaten natuurlijk onwenselijk zijn, is enige nuancering op zijn plaats. Ten eerste moet worden benadrukt dat een incomplete DDPS betekent dat de samenvatting van het farmacovigilantie systeem niet voldoet aan de eisen gesteld door de Europese wetgeving; dit betekent echter niet dat het veiligheidssysteem op zich niet goed functioneert. Omgekeerd betekent een volledige DDPS niet dat een systeem ook daadwerkelijk naar behoren functioneert. Uiteindelijk zullen volledige systeeminspecties nodig zijn om te beoordelen of de veiligheid gewaarborgd wordt door de houder van een handelsvergunning. Desalniettemin is een onvolledige DDPS vaak een signaal dat de handelsvergunninghouder zijn farmacovigilantiesysteem niet goed op orde heeft. Dit geldt zeker voor kleine bedrijven waarvan een enkeling zelfs niet wist wat de betekenis van het begrip farmacovigilantie was. Dat kleine bedrijven soms moeite hebben om alle details van de vaak complexe regelgeving te doorgronden, is niet onbegrijpelijk. Zij kunnen eventueel een beroep doen op gespecialiseerde dienstverleners, die voor kleine en middelgrote handelsvergunninghouders de farmacovigilantie-activiteiten coördineren.
Waarom zijn de resultaten van dit onderzoek van belang? Ten eerste, omdat een systeem – waarvan niets in procedures is vastgelegd – weinig mogelijkheden heeft om een consistente benadering te garanderen. Zelfs als een dergelijk systeem toch goed functioneert, is dat vaak dankzij enkele bevlogen medewerkers. De continuïteit is dan moeilijk te waarborgen en als deze medewerkers verdwijnen, kennen hun opvolgers de procedures onvoldoende. Ten tweede zijn de resultaten van belang omdat een inadequate DDPS of zelfs het compleet ontbreken ervan een indicator vormen. Een DDPS dwingt tot systematisering en vereenvoudigt goed toezicht.
Concluderend mag gesteld worden dat de farmacovigilantiesystemen van de Nederlandse handelsvergunninghouders op een groot aantal punten tekortschieten. Hier valt nog veel te verbeteren. In ieder geval dienen registratiehouders er alles aan te doen om zowel het systeem als de samenvatting ervan op orde te hebben. Naar aanleiding van dit onderzoek worden inmiddels risicogestuurde inspecties verricht en is het sanctie- en handhavingsbeleid aangescherpt.
D.W. Loth, toezichtsmedewerker
R. Ruiter, toezichtsmedewerker
E.M. Rodenburg, toezichtsmedewerker
B.H.Ch. Stricker, senior-inspecteur
Allen bij de sectie Geneesmiddelenbewaking, Inspectie voor de Gezondheidszorg, Den Haag
Referenties
1. Volume 9 Pharmacovigilance – Rules for Medicinal Products for Human and Veterinary Use, 20 December 2001. Update September 2008: Volume 9A Pharmacovigilance – of the Rules Governing Medicinal Products in the European Union – Guidelines on Pharmacovigilance for Medicinal Products for Human Use.
2. Geneesmiddelenwet.
Tabel 1. Required elements of the Detailed Description of the Pharmacovigilance System
2.2.3.a) Qualified Person Responsible for Pharmacovigilance (QPPV)
1: name QPPV
2: Marketing Authorisation Application form.
3: summary Curriculum Vitae of the QPPV
4: summary of the job description of the QPPV
5: back-up procedure for the QPPV
2.2.3.b) Organisation
6: company units (identification and location) where pharmacovigilance activities are undertaken.
7: location main databases
8: location Individual Case Safety Reports collection and reporting.
9: location of preparation and processing of the PSURs
10: identification of points of accessibility of pharmacovigilance data.
11: high level organisation charts providing an overview of the pharmacovigilance units and organisations. Including main reporting relationships.
12: brief summary of the pharmacovigilance activities undertaken by each of the organisations/units in point 11.
13: flow diagrams indicating the flow of safety reports.
2.2.3.c) Documented Procedures
14: Activities of the QPPV and the back-up procedure to apply in their absence;
15: The collection, processing (including data entry and data management), quality control, coding, classification, medical review and reporting of ICSRs for reports of different types.
16: Follow-up of reports for missing information and for information on the progress and outcome of the case(s);
17: Detection of duplicate reports;
18: Expedited reporting;
19: Electronic reporting;
20: Periodic Safety Update Reports (PSURs): The preparation, processing, quality control, review (including medical review) and reporting;
21: Global pharmacovigilance activities applying to all products: Continuous monitoring of the safety profile of authorised medicinal products (product-specific risk management systems and pharmacovigilance planning are covered in Chapter I.3.)
22: Interaction between safety issues and product defects;
23: Responses to requests for information from regulatory authorities;
24: Handling of urgent safety restrictions and safety variations;
25: Meeting commitments to Competent Authorities in relation to a marketing authorisation;
26: Management and use of databases or other recording systems;
27: Internal audit of the pharmacovigilance system;
28: Training;
29: Archiving.
2.2.3.d) Databases
30: listing of the main databases used for pharmacovigilance purposes.
31: brief functional description of the databases + a statement regarding the validation.
32: statement regarding the compliance of the systems with internationally agreed standards as referred to in part III.
33: copy of the registration of the QPPV with the EudraVigilance system.
34: indication of the responsibility for the operation of the databases and their location.
2.2.3.e) Contractual Arrangements with Other Persons or Organisations Involved in the Fulfilment of Pharmacovigilance Obligations
35: outline of the major subcontracting arrangements of the company for pharmacovigilance activities.
36: brief description of the nature of the agreements mentioned in V35.
2.2.3.f) Training
37: brief description of the training system.
38: Location of Curricula Vitae and job descriptions.
2.2.3.g) Documentation
39: brief description of the location of the different types of pharmacovigilance source documents including archiving arrangements.
2.2.3.h) Quality Management System
40: brief description of the quality management system.
41: brief description of the responsibilities for quality assurance auditing of the pharmacovigilance including auditing of sub-contractor
| Onderdelen | |
| Afwezig in meer dan 25% van de DDPS-en | 7, 10, 17, 21, 22, 23, 24, 25, 32, 33, 34, 41 |
| Afwezig in 20-25% van de DDPS-en | 5, 9, 11, 14, 16, 19, 26, 27, 28, 29, 35, 38 |
| Aanwezig in meer dan 80% van de DDPS-en | 1, 2, 3, 4, 6, 8, 12, 13, 15, 18, 20, 30, 31, 36, 37, 39, 40 |
- Er zijn nog geen reacties
















